- Deutsch
- English (Englisch)
Treibermutationen
Nicht-kleinzelliges Bronchialkarzinom (NSCLC)
Treibermutationen beim Lungenkrebs
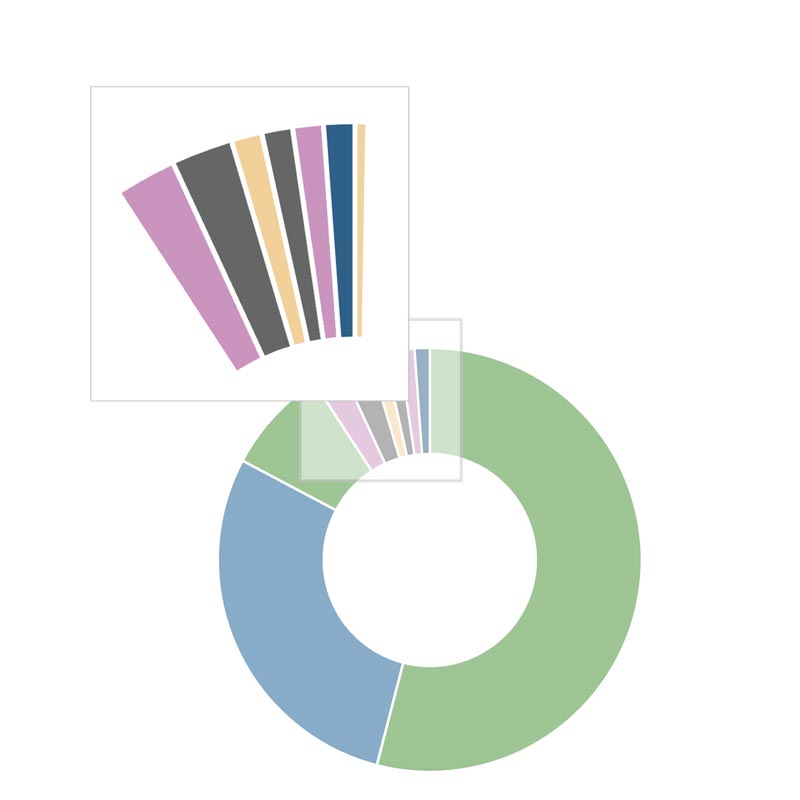
Veränderungen im Genom der Lungenkrebszelle, die dem malignen Wachstum der Krebszelle zugrunde liegen, werden zusammenfassend Treibermutationen genannt. Dabei kann es sich um Mutationen im engeren Sinn (Austausch der DNA-Bausteine im Genom der Krebszelle), aber auch um den Verlust von Genabschnitten (Deletion), um Genbrüche, die zu einer Verschmelzung mit neuen Genabschnitten führen (Fusionen, Translokationen) oder um Vervielfältigungen von Genen oder Genabschnitten (Amplifikationen) handeln. Findet sich keine Mutation bei der molekularen Diagnostik in einem der untersuchten Gene, wird der Befund als Wildtyp bezeichnet.
Solche Treibermutationen können mittlerweile in den Tumoren von ca. 50% der Patienten mit einem Adenokarzinom, der häufigsten Form des nicht-kleinzelligen Lungenkarzinoms (NSCLC), gefunden werden. Beim Plattenepithelkarzinom liegt die Häufigkeit aktuell nur bei ca. 5-10%. Bei großzellig-neuroendokrinen NSCLC und beim kleinzelligen Lungenkarzinom werden Treibermutationen in der Regel nicht gefunden.
In unserer Diagrammen sind nur Treibermutationen gelistet, für die es schon zielgerichtete Medikamente gibt. Zum Teil sind diese bereits in Europa zugelassen, zum Teil besteht die Möglichkeit einer Therapie außerhalb der Zulassung (off-label), im Rahmen klinischer Studien oder durch den Import bei Zulassung außerhalb der EU.
Bei den modernen Verfahren der Tumorgenom-Analyse (dem sogenannten Next-Generation-Sequencing) werden auch häufig Mutationen gefunden, die keine therapeutische Bedeutung haben. Diese sind in der nachfolgenden Diagrammen nicht aufgeführt.
Treibermutationen
Adeno- und Plattenepithelkarzinom
Über aktuelle klinische Studien im nNGM können Sie sich unter https://www.nngm.de/studien/ informieren.
Finden sich keine genetischen Veränderungen, liegt für das spezifische Gen ein Wildtyp vor (zum Beispiel EGFR Wildtyp bei Fehlen von Mutationen im EGFR-Gen). In dem Fall gibt es keine Möglichkeit einer zielgerichteten Therapie, da kein spezifischer Treiber gehemmt werden kann.
KRAS Mutationen sind schon seit über 40 Jahren beim NSCLC und anderen Tumoren beschrieben Beim NSCLC beträgt die Häufigkeit ca. 25% bei Adenokarzinomen und nur 1-2% bei Plattenepithelkarzinomen. Diese Mutationen treten v.a. bei langjährigen Rauchern auf. Es gibt verschiedene Typen von KRAS Mutationen, der häufigste Typ beim NSCLC ist die KRAS G12C Mutation. Zahlreiche KRAS Inhibitoren werden in klinischen Studien erprobt, bisher ist nur das Medikament Sotorasib in den USA nach Versagen von Chemoimmuntherapie zugelassen. In Deutschland steht das Sotorasib im Rahmen eines Compassionate Use Programms zur Verfügung, jedoch erst nach Versagen der Chemoimmuntherapie. Aufgrund der höheren Wirksamkeit in der Erstlinie bleibt hier die Chemoimmuntherapie bzw. bei hohem PD-L1 Status die Immuntherapie weiterhin die Standardbehandlung.
Bei ca. 90% der EGFR-Mutationen handelt es sich um sogenannte typische EGFR-Mutationen (zumeist Exon 19 Deletionen, Exon 21 (L858R) Mutation). Diese finden sich gehäuft, aber nicht nur, bei Frauen und Nierauchern mit Adenokarzinom. Zahlreiche EGFR-TKIs der ersten (Erlotinib, Gefitinib), zweiten (Afatinib) und der dritten (Osimertinib) Generation sind zur Therapie ab der Erstlinie zugelassen. Aufgrund ihrer guten Verträglichkeit, längerer Wirksamkeit und Wirkung im Gehirn werden in der Regel EGFR-TKIs der dritten Generation in der Erstlinie verordnet.
Bei einem Rezidiv unter EGFR-TKIs sollte eine Rebiopsie einer wachsenden Tumorläsion erwogen werden. Bei einem Teil der Patienten finden sich dann Resistenzmutationen im EGFR selbst (z.B. T790M, C797S u.a.) oder die Aktivierung neuer Treibermutationen (z.B. METamp), die man gezielt behandeln kann. Auf diese Möglichkeit sollten Sie Ihren behandelnden Onkologen ansprechen oder eine Zweitmeinungssprechstunde im nNGM in Anspruch nehmen. Findet sich kein Resistenzmechanismus bei Versagen der Therapie mit einem Drittgenerations-TKI, ist eine Platin-basierte Chemotherapie (ggf. mit Zusatz eines Immuncheckpointinhibitors und/oder eines Angiogenesehemmers) die Standardtherapie.
Neben den typischen EGFR Mutationen gibt es noch die selteneren atypischen EGFR Mutationen. Eine Wirksamkeit ist bei diesen Mutationen für die EGFR TKIs Afatinib und Osimertinib gezeigt, allerdings wesentlich schwächer im Vergleich zu den typischen EGFR Mutationen. Die Entscheidung über den Einsatz von EGFR TKIs (Medikament, Zeitpunkt) muss daher individuell erwogen werden.
Eine dritte Gruppe von EGFR Mutationen sind die sogenannten EGFR Exon 20 Insertionsmutationen (EGFRex20).
ALK Fusionen finden sich fast ausschließlich bei Adenokarzinomen, gehäuft bei jüngeren Patienten und Nierauchern. ALK-TKIs der ersten (Crizotinib), und zweiten (Alectinib, Brigatinib) Generation sind zur Erstlinientherapie zugelassen. Aufgrund ihrer längeren Wirksamkeit, ihrer guten Verträglichkeit und ihrer Wirkung im Gehirn werden in der Regel ALK-TKIs der zweiten Generation in der Erstlinie verordnet.
Lorlatinib, ein Drittgenerationsinhibitor, ist im Rezidiv unter ALK-TKI Therapie zugelassen.
Bei einem Rezidiv unter ALK-TKIs sollte eine Rebiopsie einer wachsenden Tumorläsion erwogen werden. Bei einem Teil der Patienten finden sich dann Resistenzmutationen im ALK Gen selbst oder (selten) die Aktivierung neuer Treibermutationen (z.B. METamp), die man gezielt behandeln kann. Auf diese Möglichkeit sollten Sie Ihren behandelnden Onkologen ansprechen oder eine Zweitmeinungssprechstunde im nNGM in Anspruch nehmen.
Findet sich kein Resistenzmechanismus bei Versagen der Therapie mit einem ALK-Inhibitor und ist die Behandlung mit Zweit-und Drittgenerationsinhibitoren ausgereizt, ist eine Platin-basierte Chemotherapie (ggf. mit Zusatz eines Immuncheckpointinhibitors und/oder eines Angiogenesehemmers) die Standardtherapie. Die Immunmonotherapie (Gabe eines Checkpointinhibitors ohne Chemotherapie) ist bei ALK positivem NSCLC kaum wirksam und sollte nur aussnahmsweise nach Versagen aller anderen Optionen in Erwägung gezogen werden.
Mutationen im BRAF Gen finden sich fast ausnahmslos in Adenokarzinomen. BRAF Mutationen teilen sich in verschiedene Untergruppen auf. Nur die BRAF V600 Mutationen (zumeist BRAF V600E) sind bisher mit zielgerichteten Therapien behandelbar. Hier ist die Kombination der TKIs Dabrafenib (ein BRAF-Inhibitor) und Trametinib (ein MET-Inhibitor) die wirksamste und bereits in der Erstlinie zugelassene Therapie. Nächstgenerationsinhibitoren, die auch bei Versagen dieser Therapie wirksam sind, stehen noch nicht zur Verfügung. Im Rezidiv ist daher die Platin-basierte Chemotherapie, ggf. in Kombination mit einem Immuncheckpointinhibitor, die Therapie der Wahl. Bei einem erneuten Rezidiv empfehlen wir auch hier, wenn unkompliziert möglich, die Rebiopsie einer wachsenden Läsion und ihre molekulardiagnostische Aufarbeitung.
Amplifikationen des MET Gens können sowohl als primäre Treibermutationen (d.h. ohne andere Treibermutationen) vorkommen als auch als Resistenzmechanismus bei Behandlung mit anderen Kinaseinhibitoren (z.B. EGFR-Inhibitoren). In beiden Fällen ist die Wirkung von MET-Inhibitoren abhängig vom Ausmaß der Amplifikation, d.h. von der Anzahl der vervielfältigten Gen- oder Genabschnittskopien. MET-Inhibitoren sind besonders wirksam bei hochamplifizierten (high-level Amplifikation) Tumoren.
Stellt die MET Amplifikation die primäre Treibermutation dar, sollte in der Erstlinie wg. der höheren Wirksamkeit zunächst mit Chemoimmuntherapie oder (bei hohem PD-L1 Status) mit Immuntherapie behandelt werden. Erst nach Versagen von Chemoimmuntherapie kann hier eine Therapie mit einem MET-Inhibitor erwogen werden. Da in dieser Situation bisher kein MET-Inhibitor zugelassen ist, muss diese Therapie dann off-label erfolgen. Zur Verfügung stehen hier Crizotinib oder die neueren Inhibitoren Capmatinib und Tepotinib (die beiden letzteren aktuell erst nach Import über eine internationale Apotheke).
Wird die MET Amplifikation in der Rebiopsie nach Versagen einer Kinaseinhibitortherapie für eine andere Treibermutation (z.B. EGFR, ALK u.a.) festgestellt, kann individuell die Kombinationstherapie aus dem ursprünglich gegebenen Inhibitor (z.B. einem EGFR-Inhibitor) und einem MET-Inhibitor erwogen werden. Die Wirksamkeit dieses Ansatzes wurde insbesondere bei der Resistenz auf EGFR-Inhibitoren gezeigt, ist aber auch noch nicht zugelassen und muss daher off-label erfolgen. Standardtherapie in dieser Situation wäre eine Chemotherapie (ggf. mit Immuntherapie und/oder antiangiogenetischer Therapie).
RET Fusionen finden sich v.a. bei Adenokarzinomen und gehäuft, aber nicht ausschließlich, bei Nierauchern. Die RET-Inhibitoren Selpercatinib und Pralsetinib sind in Europa für die Behandlung des RET positiven NSCLC zugelassen, allerdings erst nach Versagen von Chemo- und/oder Immuntherapie. Aufgrund ihrer hohen und langandauernden Wirksamkeit, ihrer guten Verträglichkeit und ihrer exzellenten ZNS-Wirksamkeit, sollte bei der Diagnose einer RET-Fusion im Rahmen der Erstdiagnose allerdings eine off-label Erstlinienbehandlung erwogen werden.
ROS1 Fusionen finden sich fast ausschließlich bei Adenokarzinomen, gehäuft bei jüngeren Patienten und Nierauchern. In der Erstlinientherapie zugelassen und Standard sind die Präparate Crizotinib (ein kombinierter ALK-, ROS1-, MET- Inhibitor) und Entrectinib (ein kombinierter ALK-, ROS1-, TRK-Inhibitor), letzteres hat eine höhere ZNS-Wirksamkeit. Im Rezidiv wird i.d.R. das Lorlatinib eingesetzt. Da es nur für das ALKfus positive NSCLC zugelassen ist, handelt es sich hier um einen off-label Einsatz. Weitere TKIs können off-label (z.B. Cabozantinib) oder im Rahmen klinischer Studien (z.B. Repotrectinib) eingesetzt werden. Bei ROS1 positiven Patienten wirkt eine Platin-haltige Chemotherapie i.d.R. besser als bei anderen NSCLC-Patienten, oft auch wiederholt im Rezidiv.
Bei einem Rezidiv unter ROS1-TKIs sollte eine Rebiopsie einer wachsenden Tumorläsion erwogen werden. Bei einem Teil der Patienten finden sich dann Resistenzmutationen im ROS1 Gen, die eine gezieltere Auswahl der nachfolgenden Therapie erlauben. Auf diese Möglichkeit sollten Sie Ihren behandelnden Onkologen ansprechen oder eine Zweitmeinungssprechstunde im nNGM in Anspruch nehmen.
Die Immunmonotherapie (Gabe eines Checkpointinhibitors ohne Chemotherapie) ist bei ROS1 positivem NSCLC kaum wirksam und sollte nur aussnahmsweise nach Versagen aller anderen Optionen in Erwägung gezogen werden.
Die HER2 Exon 20 Insertionsmutationen kommen v.a. bei Adenokarzinomen vor. Sie sind eine heterogene Gruppe von Mutationen und eng verwandt zu den EGFR Exon 20 Insertionsmutationen. Für diese Gruppe befinden sich aktuell spezifische Inhibitoren in der klinischen Prüfung. Wirksamkeit zeigte in einer klinischen Stufe bei Patienten mit Rezidiv nach Chemoimmuntherapie u.a. das Antikörper-Wirkstoff-Konjugat Trastuzumab-Deruxtecan. Es besteht aus einem gegen den HER2 Rezeptor gerichteten Antikörper, an den ein Chemotherapeutikum gekoppelt ist. Das Medikament ist in den USA beim Mammakarzinom zugelassen und kann für einen off-label Einsatz über die internationale Apotheke bezogen werden. Es sollte erst nach Versagen von Chemoimmuntherapie eingesetzt werden, eine Kostenübernahmeerklärung muss bei der Krankenkasse erfragt werden. Auch das Trastuzumab-Emsatine ist ein Antikörper-Wirkstoff-Konjugat, das für das Mammakarzinom, auch in Deutschland, zugelassen ist und für welches Wirksamkeit beim HER2 mutierten NSCLC gezeigt wurde.
Auch hier sollte ein off-label Einsatz aber erst nach dem Versagen der Chemoimmuntherapie erwogen werden.
Aktivierende und damit behandelbare Fusionen in den NTRK Genen 1-3 finden sich bei einer Vielzahl von malignen Tumoren im Kindes- und Erwachsenenalter. Sie sind beim NSCLC sehr selten mit einer Häufigkeit von unter 0.5%. In Europa sind die Medikamente Larotrectinib (ein TRK-Inhibitor) und Entrectinib (ein kombinierter ALK-, ROS1- und TRK-Inhibitor zugelassen und werden ab der Erstlinienbehandlung empfohlen.